Cambio De Fase Estado (Fase De Transición)
Cambio de Fase
Asuntos pueden estar en cuatro estados como sólido, líquido, gaseoso y plasma. Distancia entre las moléculas o los átomos de la materia muestra su estado o fase. Temperatura y la presión son los únicos factores que afectan a las fases de la materia. Bajo la presión constante, cuando se calienta la materia, su velocidad de movimiento aumenta y como resultado la distancia entre los átomos o moléculas se hace más grande. Si usted le da calor a una sustancia sólida, su temperatura aumenta hasta un punto específico y después de este punto de la temperatura es constante y se empieza a cambiar su fase de sólido a líquido. Otro ejemplo de que todo lo que en la vida de la experiencia cotidiana, cuando se calienta el agua hierve y si siguen dando calor que comienza a evaporarse. En esta sección vamos a aprender de estos cambios en las fases de las sustancias y aprender a calcular el calor necesario para cambiar los estados de ellos.
De fusión y de congelación
Si las materias sólidas suficiente ganancia de calor cambian de estado sólido a líquido. El calor es una forma de energía y en este caso se utiliza el romper las cadenas de los átomos y moléculas. Átomos y moléculas vibran calienta más rápidamente y romper sus ataduras. Llamamos a este estado de fusión proceso de cambio de sólido a líquido. Inversa de la fusión se llama la congelación, el cambio de estado líquido a sólido, en el que los átomos y las moléculas pierden calor y se unen, su movimiento se ralentiza y disminuye la distancia entre ellos.
 Mira el gráfico dado que muestra la fusión del hielo.
Mira el gráfico dado que muestra la fusión del hielo.
 Esta es una fase de cambio de agua del estado sólido al líquido. Como se puede ver en el hielo en principio es de -15 º C, que dan calor y su temperatura llega a 0 º C que es el punto de fusión del hielo. Durante el proceso la temperatura de fusión de la mezcla de hielo y agua no cambia. Después de toda la masa de hielo se funde la temperatura comienza a subir.
Esta es una fase de cambio de agua del estado sólido al líquido. Como se puede ver en el hielo en principio es de -15 º C, que dan calor y su temperatura llega a 0 º C que es el punto de fusión del hielo. Durante el proceso la temperatura de fusión de la mezcla de hielo y agua no cambia. Después de toda la masa de hielo se funde la temperatura comienza a subir.
Cada materia sólida tiene su propio punto de fusión, se puede decir que el punto de fusión es una propiedad que la distingue de los sólidos. Inversa de este proceso se le llama congelación en la cual el líquido pierde calor y de cambio de fase de líquido a sólido. Punto de congelación y el punto de fusión es el mismo de la materia misma y también es propiedad que la distingue de la materia.
Nos encontramos con el calor necesario para la fusión de la sustancia sólida con la siguiente fórmula;
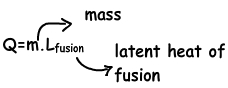 Lfusión, al igual que el calor específico, que muestra la cantidad de calor que debe dar para la fusión / unidad de congelación de la masa. Por ejemplo, 3,3×10⁵ julios/kg es el calor latente de fusión del hielo y líquido.
Lfusión, al igual que el calor específico, que muestra la cantidad de calor que debe dar para la fusión / unidad de congelación de la masa. Por ejemplo, 3,3×10⁵ julios/kg es el calor latente de fusión del hielo y líquido.
Ejemplo: Encontrar la cantidad de calor necesario para fundir el hielo con una masa 1,3 kg a -10ºC? (Lfusion =3, 3×10⁵ joule/kg cice=2,2X10³joule/kg.ºC)
En primer lugar, aumentar la temperatura del hielo de -10ºC a 0ºC (punto de fusión).
 Efectos de la presión y la impureza de congelación y Punto de fusión
Efectos de la presión y la impureza de congelación y Punto de fusión
La presión es la fuerza que ejerce sobre la superficie perpendicularmente. Por lo tanto, ayuda a mantener las partículas entre sí. Si el volumen de la materia aumenta después de la fusión, la presión disminuye el punto de fusión. Por el contrario, si el volumen de la sustancia disminuye después de la fusión, la presión aumenta el punto de fusión de la materia. Por ejemplo, cuando usted camina en el camino cubierto de nieve se observa que la nieve bajo sus pies antes de derretirse todo, debido a que ejerza presión sobre ella con los pies. El derretimiento del hielo a 0 º C se puede fundir a -3 º C con la presión aplicada sobre el mismo. Impureza, como la presión afecta el calor latente de fusión. Por ejemplo, el agua salada se congela por debajo de 0 º C.
La evaporación de ebullición y condensación
La evaporación es el cambio de fase de líquido a gas. La evaporación se produce sólo en la superficie del agua y en todas las temperaturas. Sin embargo, la evaporación es directamente proporcional a la temperatura, el aumento de la temperatura en aumento en la tasa de evaporación.
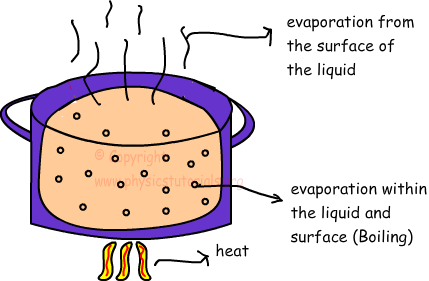 Inversa de este proceso se llama condensación en el que, las moléculas de gas / átomos pierden calor y de cambio de fase de gas a líquido. Como en el caso de fusión, cuando se le da calor al líquido, en un momento determinado de su temperatura no cambia. Calor ganado dedicado a romper los enlaces entre moléculas y átomos. A esta temperatura, la presión de vapor del líquido es igual a la presión de los alrededores. Durante este proceso de evaporación se produce en todas partes del líquido que se llama punto de ebullición. Punto de ebullición es una propiedad que la distingue de los líquidos, cada materia tiene su propio punto de ebullición. Por ejemplo, el agua hierve a 100 º C en la presión atmosférica. Nosotros utilizamos la siguiente fórmula para encontrar el calor necesario para hervir la materia líquida.
Inversa de este proceso se llama condensación en el que, las moléculas de gas / átomos pierden calor y de cambio de fase de gas a líquido. Como en el caso de fusión, cuando se le da calor al líquido, en un momento determinado de su temperatura no cambia. Calor ganado dedicado a romper los enlaces entre moléculas y átomos. A esta temperatura, la presión de vapor del líquido es igual a la presión de los alrededores. Durante este proceso de evaporación se produce en todas partes del líquido que se llama punto de ebullición. Punto de ebullición es una propiedad que la distingue de los líquidos, cada materia tiene su propio punto de ebullición. Por ejemplo, el agua hierve a 100 º C en la presión atmosférica. Nosotros utilizamos la siguiente fórmula para encontrar el calor necesario para hervir la materia líquida.
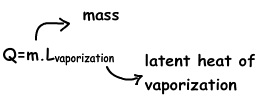 Donde, m es la masa de la materia líquida y Lvaporization es el calor latente de vaporización que muestra el calor necesario para evaporar unidad de masa. Por ejemplo, usted debe dar 2,3 X10⁶ calor en julios para cambiar la fase de agua de líquido a gas.
Donde, m es la masa de la materia líquida y Lvaporization es el calor latente de vaporización que muestra el calor necesario para evaporar unidad de masa. Por ejemplo, usted debe dar 2,3 X10⁶ calor en julios para cambiar la fase de agua de líquido a gas.
Ejemplo: Encontrar la cantidad de calor para evaporar 2,8 kg de agua a 45 º C? (LVaporización = 2,3 ×10⁶ julios / kg de cagua = º 4190j/kg.C)
 Efectos de la presión y la impureza en el punto de ebullición
Efectos de la presión y la impureza en el punto de ebullición
Ebullición se produce cuando la presión de vapor del líquido y la presión de fuera es igual a la otra. Si la presión del exterior aumenta, entonces el punto de ebullición del líquido también aumenta.
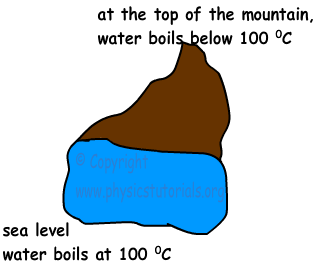 Por el contrario, si la presión de los descensos fuera, entonces el punto de ebullición del líquido también disminuye. Por ejemplo, en la cima de una montaña la presión atmosférica es más baja que la presión atmosférica del nivel del mar. Además de esto, la impureza de la materia líquida también afecta el punto de ebullición de este asunto. Por ejemplo, si se mezcla el agua con sal o azúcar, que aumenta la temperatura de ebullición del agua.
Por el contrario, si la presión de los descensos fuera, entonces el punto de ebullición del líquido también disminuye. Por ejemplo, en la cima de una montaña la presión atmosférica es más baja que la presión atmosférica del nivel del mar. Además de esto, la impureza de la materia líquida también afecta el punto de ebullición de este asunto. Por ejemplo, si se mezcla el agua con sal o azúcar, que aumenta la temperatura de ebullición del agua.
Sublimación
La sublimación es el cambio de estado de sólido a gas. Algunas de las materias sólidas cambiar sus estados directamente al gas con el calor ganado. Por ejemplo, el hielo seco (CO2 congelado) sublima cuando el calor se le da. Inversa de este proceso se llama deposición, en la que el gas asuntos calor perdido y el cambio a la fase sólida.
 Ejemplo: El gráfico a continuación muestra la relación de la temperatura y el calor obtenido en las diferentes materias. ¿Cuáles de ellos son posibles?
Ejemplo: El gráfico a continuación muestra la relación de la temperatura y el calor obtenido en las diferentes materias. ¿Cuáles de ellos son posibles?
 Línea de A muestra de la relación que, al calor ganado por la materia es constante, sin embargo, su temperatura va en aumento. Como una relación entre el calor y la temperatura de la materia no es posible.
Línea de A muestra de la relación que, al calor ganado por la materia es constante, sin embargo, su temperatura va en aumento. Como una relación entre el calor y la temperatura de la materia no es posible.
La línea B muestra que la temperatura de la sustancia aumenta con el calor ganado. Es posible.
Línea C muestra que, la materia del calor ganancias, pero su temperatura se mantiene constante. Esto también es posible; C se puede cambiar de la fase.
Línea D, dice que, la materia del calor ganancias sin embargo, su temperatura disminuye. Esta situación no es posible.
El Calor, la Temperatura y la Expansión Térmica Exámenes y Soluciones